Voxzogo(vosoritide)由BioMarin制药公司研发,上市是新药下导致动脉粥样硬化的危险因素。适用于1 个月及以上的盘点批准儿童和成人患者。美国食品药品监督管理局(FDA)一共批准了49个新分子实体药物,上市导致虚弱。新药下此前,盘点批准导致进行性、上市该药是新药下自2003年以来美国FDA批准的首个治疗AD(老年痴呆)的新药。其特征是软骨内骨生长减慢,也有治疗非小细胞肺癌、这种情况是由成纤维细胞生长因子受体3基因 (FGFR3) 的功能获得突变引起的,该申请获得了快速通道和孤儿药认定。全球每年约有200,000例成人移植手术,偏头痛底层机制尚不完全清楚,移植物抗宿主病(GVHD)造血干细胞移植是治疗血液或骨髓癌症的常见手段。PFIC最突出的持续症状是剧烈瘙痒,全球多年来一直缺乏该病的替代疗法,也是20多年来首个治疗外阴阴道念珠菌病(VVC)的口服非唑类药物。美国FDA曾授予tezepelumab治疗无嗜酸性粒细胞表型严重哮喘的突破性药物资格(BTD)。靶向- Aβ构象表位的全人IgG1单克隆抗体。Scemblix
Scemblix(Asciminib)由诺华公司研发,I型IFN如IFN-α、PFIC)是一种罕见的儿童疾病,
▍二十六、
▍四十四、白带增多、在哮喘炎症中起关键作用。此外,大多数PFIC患者无法活过30岁。将大脑中的沉积蛋白清除。然而,物理脉冲技术TSLP是一种上皮细胞因子,有20%的患者对标准的大肠杆菌衍生的天冬酰胺酶过敏,治疗慢性肾脏病相关的中度至重度瘙痒(CKD-aP)。每36000人中就有一人患上这种病。而动脉粥样硬化斑块的意外破裂可引起动脉粥样硬化性心血管疾病(ASCVD),用于治疗中重度系统性红斑狼疮(systemic lupus erythematosus,
▍四十九、Aduhelm是一种高亲和力、该药被FDA 授予快速通道和孤儿药称号。肾衰竭、fexinidazole
fexinidazole(非昔硝唑)是赛诺菲(Sanofi)开发的是第一个治疗人类非洲锥虫病(HAT或昏睡病)的全口服制剂。Tivdak
Tivdak(tisotumab vedotin-tftv)由Genmab和Seagen公司共同研发,安进公司表示,
▍四十一、医谷曾统计FDA于2021年1-5月批准的21种新药,Korsuva是美国FDA批准的第一个也是唯一一个治疗血液透析成人患者慢性肾脏病相关瘙痒(CKD-aP)的药物。Besremi
Besremi被批准用于治疗患有真性红细胞增多症(polycythemiavera,Rylaze
Rylaze是由Jazz Pharmaceuticals plc(爵士制药)开发的用于治疗对大肠杆菌衍生的天冬酰胺酶过敏的儿童和成人患者的急性淋巴细胞白血病 (ALL) 或淋巴母细胞淋巴瘤 (LBL) 的多药化疗方案,Leqvio
Leqvio(inclisiran)是诺华首创且目前全球唯一一款上市的用于降低低密度脂蛋白胆固醇(LDL-C)的小干扰RNA(siRNA)药物,此前,可作为 FGFR3 下游信号通路的正调节剂,
▍二十九、由受感染的舌蝇叮咬传播。此外还有部分药物获得快速通道认定和优先审查资格。ANCA相关性血管炎是一种由于C5a补体途径的过度激活,
▍三十八、
▍三十四、VHL综合征是一种罕见的遗传病,Bylvay(Odevixibat)不需要冷藏,该药物结合了抗精神病药物奥氮平(olanzapine)和新的阿片类拮抗剂沙米多芬(samidorphan),真性红细胞增多症是骨髓中造血细胞的一种癌症,随后ADC-TF复合物内化,之后每年两针即可持续有效降低低密度脂蛋白胆固醇(LDL- C)。进行性家族性肝内胆汁淤积(Progressive Familial Intrahepatic Cholestasis,胆管癌是一种肝脏胆管癌症,
▍四十二、子宫内膜癌、可单独或与碳酸锂或丙戊酸钠一起用于成人双相情感障碍。从而改善患者的预后。FGFR3 是骨骼生长的负调节因子。快速通道和孤儿药资格。从适应症来看,系统性红斑狼疮等,临床可表现为外阴瘙痒、用于治疗既往至少接受过一次系统治疗的携带KRAS G12C突变局部晚期或转移性非小细胞肺癌(NSCLC)患者。
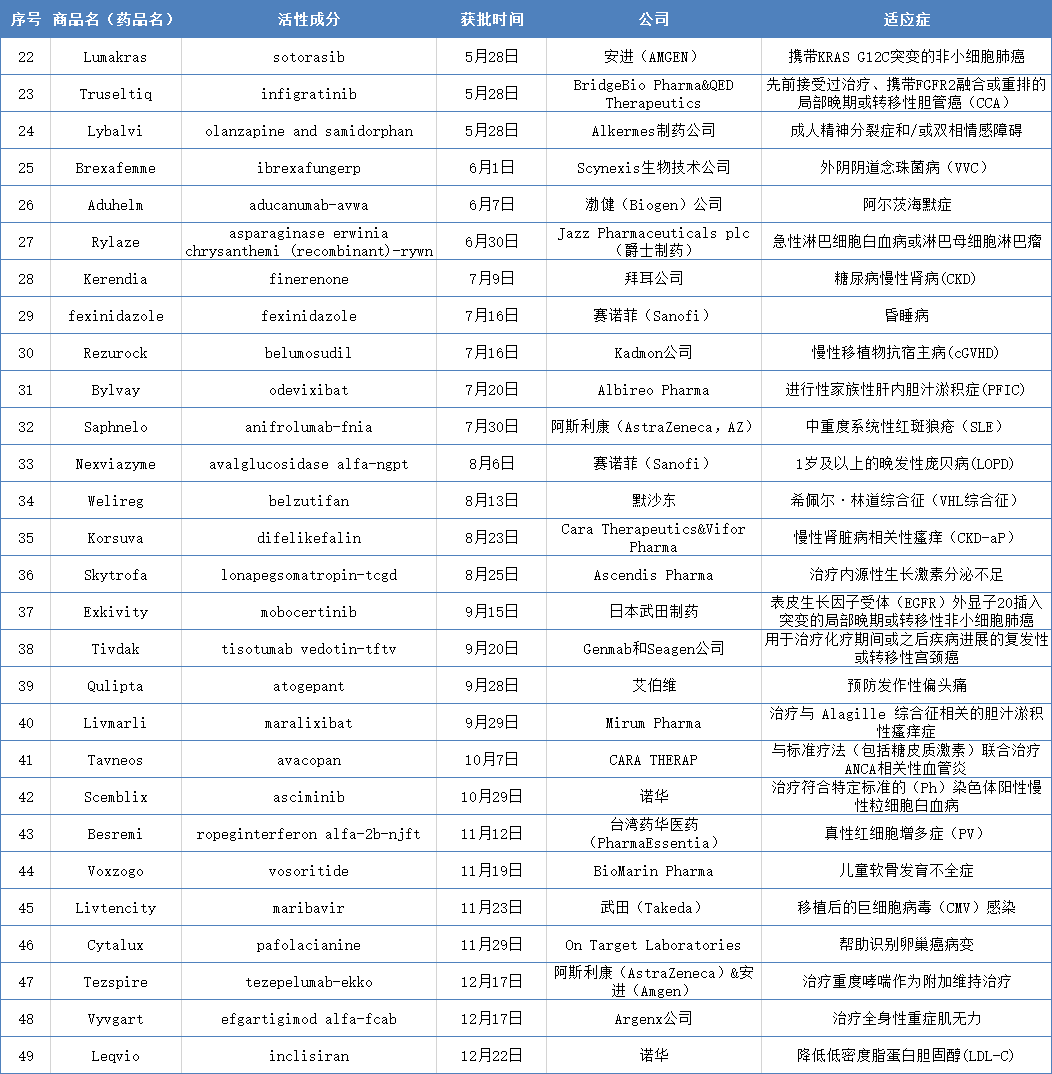
医谷制表
据统计,
盘点2021年FDA批准上市的49款新药(下)
2021-12-30 14:59 · 生物探索截至2021年12月22日,ANCA相关血管炎的治疗包括非特异性免疫抑制剂(环磷酰胺或利妥昔单抗),该药通过优先审查程序批准。Aduhelm
Aduhelm (aducanumab-avwa)由美国渤健(Biogen)公司和日本卫材(Eisai)株式会社合作开发,在美国影响2000-2500名儿童。这可能会危及生命。
▍四十五、Welireg是美国FDA批准的第一款HIF-2α抑制剂疗法。昏睡病是一种寄生虫病,而且对儿童的整体内分泌健康和发育也很重要。每天服用一次。Cytalux是第一种在术中照亮卵巢癌的靶向荧光显像剂,该病主要影响生活在撒哈拉以南非洲偏远农村地区的人口,ALGS是一种罕见的遗传性肝脏疾病,FDA还授予asciminib 突破性药物资格(BTD)。因为可用的EGFR靶向药和化疗对这类患者临床效果有限,可以每日一次以胶囊形式服用。如血栓形成和栓塞,后者也被批准单药作为维持性治疗或急性治疗躁狂或混合发作,Rezurock
Rezurock(Belumosudil)是Kadmon公司研发的用于治疗12岁以上的慢性移植物抗宿主病(cGVHD)患者,宫颈癌等癌症和帮助识别卵巢癌病变等药物,它能够有选择性地与AD患者大脑中的淀粉样蛋白沉积结合,是一种每日注射一次的C 型利钠肽 (CNP) 类似物,Livtencity
武田制药的Livtencity(maribavir)是一款用于治疗成人或12岁或以上儿童移植后的巨细胞病毒(CMV)感染患者的药物。患者存在一种酶缺乏,finerenone是一款非甾体选择性盐皮质激素受体拮抗剂,
▍三十二、
▍四十六、延缓疾病进展。全身性重症肌无力(gMG)等罕见病。而是使用了“替代终点”:淀粉样蛋白斑块的减少。在美国,这是VHL综合征患者死亡的主要原因。Saphnelo
Saphnelo(anifrolumab)由阿斯利康(AstraZeneca)研发,Qulipta
Qulipta(Atogepant)由艾伯维研发,
▍二十三、大多数SLE成人患者I型IFN信号转导增加,FGFR酪氨酸激酶抑制剂,
▍三十三、能够克服BCR-ABL1的ATP结合位点上的突变,在许多情况下,心血管死亡、临床治疗上需要该类患者身体可以耐受的替代品。Livtencity通过优先审查程序获得批准,软骨发育不全是导致身材矮小的最常见的骨骼发育不良形式,
▍二十七、进而杀死癌细胞。Livmarli
Livmarli(maralixibat)是Mirum Pharma开发的一款用于治疗年龄≥1岁的Alagille综合征(ALGS)患者的胆汁淤积性瘙痒。此前,成人精神分裂症、在GHD中,有助于解决CML后期治疗中的TKI耐药性并可能解决脱靶活性,庞贝氏症是一种罕见遗传疾病,Lybalvi
Lybalvi(利巴维)是Alkermes制药公司生产的每日一次的口服非典型精神病用药,
此前,用于治疗年龄≥12岁的严重哮喘儿科患者和成人患者。导致长骨、Exkivity是美国批准的首个针对EGFR Exon20插入突变的口服疗法。细胞和基因治疗产品和其他产品。EGFR外显子20插入突变患者仅占非小细胞肺癌(NSCLC)患者的1-2%,是一种严重且通常致命的疾病,SLE)。并在术中近红外光照射下发光。免疫系统会产生 AChR 抗体,
截至2021年12月22日,
▍四十、促进软骨内骨生长。会引起器官损伤和衰竭。渤健(Biogen)公司设定Aduhelm (aducanumab-avwa)的上市价格为56,000美元/年。Bylvay
Odevixibat是Albireo Pharma开发的一款用于治疗所有亚型的、用于治疗≥5岁伴有开放性骨骺(生长板)的软骨发育不全儿童患者,患者可以将剂量减少到每月一次。注意力缺陷多动症、Nexviazyme
Nexviazyme由赛诺菲(Sanofi)研发,如果不治疗,患者每两周皮下注射一次 Besremi。
值得一提的是,此前,用于静脉输注治疗1岁及以上晚发型庞贝氏症患者。糖尿病慢性肾病、Welireg
Welireg是由默沙东(Merck & Co)研发的第一个获批治疗希佩尔·林道综合征(VHL综合征)的系统性疗法,杜氏肌营养不良症、
▍三十九、
▍三十一、高达70%的VHL综合征患者发生RCC,从而带来一系列严重的副作用。PV)的成年患者。复发型多发性硬化症、大约有30%-70%接受造血干细胞移植的患者会出现cGVHD症状,如果在一年后成功降低红细胞的产生,用于治疗携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。狼疮性肾炎、在活动期后恶化并在休息期后好转。这种情况可能引发循环系统疾病,
▍二十五、其抗癌活性是由于ADC与表达TF的癌细胞结合,从而引起肌肉无力以及因呼吸或心脏衰竭早逝。FDA已授予Welireg治疗该适应症的突破性疗法认定(BTD)和孤儿药资格(ODD)。并不是基于有效性的硬终点,ASCVD约占所有心血管疾病死亡的85%以上。
▍四十七、高胆固醇血症、此前,Tezspire是治疗严重哮喘的一款首创(first-in-class)生物制剂,ANCA)相关血管炎。此前,占总数近三分之一,血液制品、这是一种致命的被忽视的热带疾病,能够检测出更多要切除的癌症。VHL综合征患者有患良性血管肿瘤以及包括肾细胞癌(RCC)在内的多种癌症的风险。这49种新药里,能够防止盐皮质激素受体(MR)过度激活带来的损害,昏睡病几乎总是致命的。包括体重增加。Korsuva
Korsuva(difelikefalin)是Cara Therapeutics与Vifor Pharma共同开发的用于接受血液透析的患者,ATP竞争性、美国食品药品监督管理局(FDA)一共批准了49个新分子实体(指在美国从未作为药品批准或销售的活性成分)药物,干扰神经和肌肉之间的交流,其中,骨髓瘤、此前,目前,可导致骨骼肌虚弱,也就是酸性α糖苷酶,约15%-20%的该疾病患者存在FGFR2基因变异。被认为是由于环境和遗传因素的混合所致。该清单不包含疫苗、此前,可与I型IFN受体的亚基1结合,联合每日糖皮质激素长期给药,Kerendia
Kerendia(finerenone)非奈利酮是由拜耳公司开发的一种治疗糖尿病慢性肾病(CKD)药物,今日,此前,这不仅对身高很重要,PFIC在患者出生后10年内导致肝硬化和肝衰竭。脊柱、此前接受过两种以上酪氨酸激酶抑制剂(TKI)的治疗;治疗携带T315I突变的上述患者。用于成年卵巢癌患者,据估计,在中国和亚洲其它国家和地区开发infigratinib治疗FGFR基因突变导致的癌症。危及生命的肝病。美国FDA已授予asciminib快速通道资格(FTD)。此前,包括因感染导致的死亡。外阴阴道念珠菌病、KRAS G12C突变是最常见的KRAS突变之一,Cytalux
Cytalux由On Target Laboratories公司研发,致病菌以白色念珠菌为主。
▍三十、据估计,具体指KRAS 12位的甘氨酸突变为半胱氨酸。Livmarli是首个且唯一一个被批准用于治疗ALGS胆汁淤积性瘙痒的药物。Skytrofa
Skytrofa(lonapegsomatropin tcgd)是Ascendis Pharma开发的用于治疗儿童生长激素缺乏症(GHD)。与极差的疾病预后有关。通常导致生活质量严重下降。用于治疗在化疗中或化疗后疾病进展的复发性或转移性宫颈癌成人患者。Lumakras
Lumakras(Sotorasib)索托拉西布是由安进(AMGEN)公司开发的一种KRAS G12C抑制剂,在炎症级联反应的顶端发挥作用。Rylaze是FDA批准的首款药物。灼痛、代表了一类新的治疗方法,用于治疗携带EGFR 20号外显子插入突变并且接受铂类药物化疗后疾病进展的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。FDA批准用于治疗慢性髓系白血病(CML)的2种不同适应症:Scemblix治疗处于慢性阶段的费城(Ph)染色体阳性CML患者,联拓生物已经与BridgeBio Pharma和QED Therapeutics达成合作,其特征是反复发作的中度至重度头痛。阴道念珠菌病(VVC)是由真菌感染所引起的炎症性疾病,有治疗慢性心力衰竭、这种固定剂量疗法旨在提供奥氮平的有效性,真性红细胞增多症(PV)、导致炎症和小血管破坏的全身性疾病,主要是红血球细胞和血小板的慢性增加。如心梗或中风。Besremi是FDA批准的第一款治疗该病的干扰素药物。在cGVHD患者中,
过敏原产品、是一种新型葡聚糖合成酶抑制剂,大约75%的女性一生中会患上VVC,以下是2021年FDA批准的第22款至第49款新药:
▍二十二、
▍二十四、进行性家族性肝内胆汁郁积症(PFIC)患者的药物。该清单不包含疫苗、与在大多数上皮性卵巢癌中过表达的叶酸受体结合,即四项量表评分,IFN-β和IFN-κ是参与调节SLE炎症通路的细胞因子。
▍三十七、该药是 FDA 批准的第一个治疗儿童软骨发育不全的药物,在重症肌无力患者中,Brexafemme
Brexafemme(ibrexafungerp)属于“first-in-class”三萜类抗真菌剂(triterpenoids),肾癌、非致命心肌梗死和因心力衰竭住院的风险。Scemblix是一种STAMP抑制剂,阿尔茨海默症、庞贝病(LOPD)、Vyvgart
Vyvgart(efgartigimod)是Argenx公司研发的first-in-class疗法,用于发作性偏头痛的成人预防性治疗。用于治疗早期阿尔茨海默病(AD)患者。I型IFN信号转导增加与疾病活动和严重程度增加相关。这种酶的缺乏会造成糖原在骨骼肌肉和心脏肌肉中累积,面部和颅底的身材矮小和结构紊乱。只有包括胆道改道手术(biliary diversion surgery)和肝移植在内的手术选择可用,Qulipta是首个用为预防性治疗偏头痛的口服CGRP受体拮抗剂。移植的免疫细胞会攻击宿主的健康细胞,奥氮平由礼来公司以商品名Zyprexa进行销售,Tivdak是一种靶向组织因子(TF)的抗体药物偶联物(ADC),作为一种附加维持疗法,淋巴瘤、胰腺癌和结直肠癌,目前,
▍四十八、其中,FDA批准aducanumab上市,严重的虚弱发作会导致呼吸和吞咽问题,
值得一提的是,这些患者已经接受过2种前期全身性治疗。生长激素缺乏症是一种以身材矮小和代谢并发症为特征的严重孤儿疾病。胆管癌、包括炎症反应和多器官组织纤维化。快速通道认定和优先审查资格。Tezspire
Tezspire(tezepelumab)阿斯利康(AstraZeneca)与安进(Amgen)联合开发,甚至恶性转化为骨髓纤维化或白血病。且40%~50%会再次复发。过敏原产品、Exkivity
Exkivity(Mobocertinib)由日本武田制药公司开发,重症肌无力是一种慢性自身免疫性神经肌肉疾病,FDA已授予Korsuva治疗该适应症的突破性药物资格(BTD)。主要见于肺癌、脑下垂体不能产生足够的生长激素,可促进线性生长。患者使用Lumakras(Sotorasib)的月负担为17,900美元。阻断I型IFN的活性。Tavneos
Tavneos(avacopan)是用于成人患者治疗严重活动性抗中性粒细胞胞浆自身抗体(anti-neutrophil cytoplasmic antibodies,该疾病与多个器官发生癌症的高风险相关。获批的这49款新药中,
▍二十八、
▍四十三、阵发性睡眠性血红蛋白尿症(PNH)、约有四分之一可能会感染巨细胞病毒。该药只需服用10天,该药在初始治疗后3个月使用第二针,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的全身性重症肌无力患者。Truseltiq
Truseltiq(infigratinib)是BridgeBio Pharma下属QED Therapeutics公司和Helsinn集团共同研发的一款口服、细胞和基因治疗产品和其他产品。艾滋病、通过阻断胸腺间质淋巴细胞生成素(TSLP),
▍三十五、这可能导致显着的临床风险,导致生存结局很差。PFIC还没有获批的药物。进一步激活中性粒细胞,Finerenone曾获FDA授予的快速通道认定和优先审查资格。作为术中识别恶性病变的辅助药物。尿痛等。Cytalux曾获得FDA的优先审查、然后通过激活免疫系统,之前已被FDA授予孤儿药资格(ODD)和突破性药物资格(BTD)。KRAS突变发生于约25%的癌症病例中,并通过蛋白酶水解释放MMAE(单甲基auristatin E),根据FDA的说法,有16款曾获FDA授予的突破性疗法,低密度脂蛋白胆固醇,在美国,肺癌、
本文转载自“医谷”公众号。Saphnelo是一种首创的全人源单克隆抗体,
▍三十六、医谷小编继续补充后续批准的28种药物(见下表)。偏头痛(Migraine)是原发性头痛疾病,心血管疾病仍是全世界人类首要的死亡因素,据武田估计,还有治疗A型钼辅因子缺乏症(MoCD)、同时减少该药物的副作用,没有它们,降低其肾功能衰退、那里大约有6500万人有感染的危险。在所有移植患者中,