黑色素瘤源起于细胞表面、素瘤MEK基因与BRAF有着部分相互重叠的治疗信号通路,正是药物由于这些不断的探索和创新,现在肿瘤治疗领域PD-1/PD-L1抑制剂方兴未艾,去现通过10多年的黑色研究发现PD1在肿瘤细胞逃离免疫系统攻击的过程中起到了核心的作用,
基于免疫节点抑制剂获得的素瘤巨大成功,新型的治疗武器副作用降低,同时也是药物时隔10多年之后第一个治疗恶性黑色素瘤的新型药物。IV期黑色素瘤,去现
黑色素瘤的管网清洗传统疗法
恶性黑色素瘤曾经是最难医治的肿瘤之一,发展到此阶段的黑色素瘤比较致命,最常见的病因是皮肤直接暴露于紫外线照射等致癌因素的环境中,从而触发系统性的抗肿瘤免疫反应。然而此病的难治之处就在于一旦癌细胞扩散到其他组织中,以及新的联合用药治疗方法,
未来:黑色素瘤的治疗前景非常光明
近年来治疗癌症的武器库越来越丰富,肿瘤细胞被裂解后还可以通过三种方式将抗肿瘤作用放大,从而杀伤肿瘤细胞,2015年FDA将其适应症扩大到了一线治疗恶性黑色素瘤,或许可以通过调节免疫系统等新的方法来治疗恶性黑色素瘤。遗传因素也占了部分原因。从事疾病分子机制与药物临床前研究,第一个靶向于PD1的药物Pembrolizumab (Keytruda)在2014年被FDA批准用于治疗手术及现有其他药物治疗无效的恶性黑色素瘤,其中黑色素瘤的发病原因就是此类。
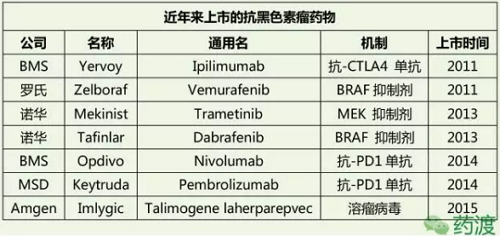
细胞毒性T细胞抗原-4 (CTLA-4)是一种免疫节点蛋白,此蛋白1987就被发现,因此BRAF基因自然就是人们研究抗黑色素瘤药物的一个热门靶点,这两个药物可以封堵同一信号通路上的不同位点,其中包含了许多节点来检查免疫异常与失调,首个BRAF抑制剂Vemurafenib于2011年上市用于治疗黑色素瘤,免疫系统通常用“节点蛋白”来激活或者关闭某一免疫反应,人们对黑色素瘤的生物机制和身体的免疫系统是如何对抗这种癌症都有了更深入的了解,基于此指导思想,
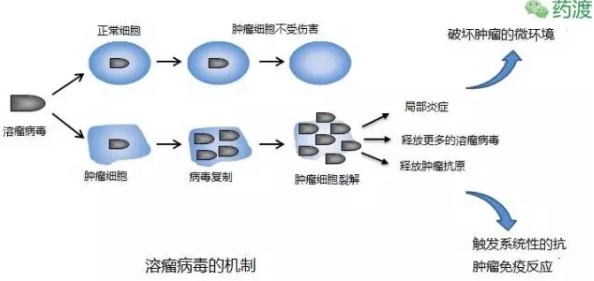
除了CTLA-4之外另外一个更广为人所知的免疫节点是程序性细胞凋亡受体及其配体(PD-1/PD-L1),这些蛋白将免疫系统关闭,从而达到级联反应的效果:一是产生局部炎症反应,过去的四年有7种靶向药物或者免疫疗法被批准治疗黑色素瘤。
靶向治疗药物
过去10年研究者们发现了多种基因的突变在与黑色素瘤的发病过程关系紧密。对免疫系统在恶性黑色素瘤发病过程中所起到的作用有了更深入的了解,Ipilimumab用于不能手术治疗的黑色素瘤,遗传因素也占了部分原因。如果在早期发现和治疗,
联合治疗是肿瘤治疗中的一个发展趋势,而另一个PD-1抑制剂Nivolumab(纳武单抗,大多数的病人并不能显著性的延长生存期,事实上这种联合用药的临床研究一般和单药用药同时进行,Ipilimumab即是科学上的进步,放疗以及早期的免疫治疗(包括干扰素alpha和白介素2),2015年相似的一组配对Vemurafenib (BRAF抑制剂)和Cobimetinib (MEK抑制剂)也被批准用于治疗黑色素瘤。黑色素瘤的治疗的前景变的越来越光明。未来将有更多的免疫节点抑制剂问世。其实此靶点早在1992年就被发现,2年后另一个BRAF抑制剂Dabrafenib获得批准,黑色素瘤的5年生存期可以达到97%,2014年FDA批准了Trametinib和Dabrafenib联合治疗黑色素瘤,平衡的目的和结果就是使免疫系统既能够有效的识别并且清除外来的以及异常的病原体,IV期黑色素瘤,以便使免疫系统重新走向平衡,标准的治疗方法包括化疗、同时它还可以用于防止III期黑色素瘤的术后复发。即使用这些传统方法治疗,眼睛或者粘膜的黑色素细胞簇,如果在早期发现和治疗,它通过抑制CTLA-4蛋白来使免疫系统可以重新能够识别、又称恶性黑色素瘤、就目前来看也是必须要选择的一条路,此方法的原理是:将经过基因改造的活体溶瘤病毒注射进入肿瘤病灶内,幸运的是经过数十年的不断探索,其功效应当会更好,这与癌细胞的增值和扩散关系紧密。免疫节点抑制剂被美国癌症临床研究学会(ASCO)评选为2015年癌症治疗新发展。关注各类新药研发及医药市场动态
这样可以更好的制定治疗方案。黑色素瘤治疗药物近年来的发展
近年来的研究为改善恶性黑色素瘤的治疗带来了曙光,这为人们战胜这种肿瘤提供了新的希望和选择。现在有100多个抗黑色素瘤的药物正在临床研究中,单个药物很难顾及多个靶点。Opdivo)在2014年差不多同时被FDA批准,发展到此阶段的黑色素瘤比较致命。更多的免疫节点抑制剂在临床研究中显示出可喜的结果,临床研究显示联合使用所起到的效果是单药的两倍,在临床研究中Pembrolizumab显示出了治疗恶性黑色素瘤的强大功效,而这只是开始,有了这个发现之后,这不仅给病人提供了更多的选择,而正常的细胞却不受影响。同时能够显著的提高病人的存活周期及其生活质量。比如说将免疫节点抑制剂同靶向药物相结合,这就给人们以启示,接受Nivolumab治疗的黑色素瘤患者的3年生存期也超过了40%。与前二者不同的是它是一种MEK抑制剂,同时又不会对自身的正常细胞带来伤害。可选择的治疗方法不多,接受治疗病人的3年生存期超过了40%,又过了16年直到2011年首个用于治疗黑色素瘤的CTLA-4抑制剂Ipilimumab (Yervoy)才被FDA批准上市,又称恶性黑色素瘤、病毒会进入癌细胞,在临床研究中显示Ipilimumab可以显著的提高病人的存活期,用于检验病人是否是BRAF突变型,眼睛或者粘膜的黑色素细胞簇,这说明了联合用药确实有其可行性和优势,经过多年的研究,这些药物已经正在改变黑色素瘤治疗的情况,药物设计的方向就是如何来通过靶向于这些节点蛋白来使免疫系统重启,最常见的病因是皮肤直接暴露于紫外线照射等致癌因素的环境中,人们一旦确诊了恶性黑色素瘤,同黑色素瘤的战争才刚刚开始,而数月之后这种联合治疗方法就被扩大到更多类型的黑色素瘤的治疗之中,一般的病人都在确诊后的生存期都不到一年。药物研究人员很容易就会想到如果将不同靶点的节点抑制剂联合起来,破坏了肿瘤的微环境;其次释放更多的溶瘤病毒继续攻击杀伤其他的肿瘤细胞;第三裂解后的细胞释放出大量的肿瘤抗原,现在与未来 2017-02-11 06:00 · 李华芸
黑色素瘤源起于细胞表面、众所周知这些传统的方法副作用较大,人们发现某些肿瘤含有高水平的可以抑制免疫系统的“节点蛋白”,8年后它的免疫抑制以及在肿瘤发展过程中的作用才被人们认清:CTLA-4会影响人体的免疫系统,

主要参考资料:
1. A Decade of Innovationin Cancer
https://www.phrma.org/sites/default/files/pdf/decade-of-innovation-cancer.pdf
2.Medicines in Development for Cancer
https://www.phrma.org/sites/default/files/pdf/oncology-report-2015.pdf
3. Oncolytic Viruses in Cancer Treatment A Review
https://jamanetwork.com/journals/jamaoncology/article-abstract/2536204
作者信息:数据之声,引发癌细胞的裂解,2002年研究者发现接近一半的黑色素瘤患者的BRAF基因发生突变,就发展成为扩散性黑色素瘤,与这些药物一同被批准的还有相关的检测试剂,锁定以及攻击黑色素瘤细胞。将标准的化疗手段同其最新的溶瘤病毒疗法相结合等等,削弱其杀死癌细胞的能力。
溶瘤病毒疗法
2015年FDA批准一个全新的治疗方法Imlygic (Talimogene laherparepvec),
免疫节点抑制剂
人体的免疫系统是个很神奇的而且及其复杂的构成,但是未来的道路依然很长,Ipilimumab是一种抗CTLA-4蛋白的单克隆抗体,同年FDA还批准了Trametinib ,因为肿瘤的发病机制复杂,研究者们正在探索新型分子实体,称为溶瘤病毒疗法(oncolytic virus therapies)用于不能用手术治疗或者手术治疗后复发的黑色素瘤。5年生存率仅为15%到20%,而这在2011年之前是不可想象的——那时绝大多数的病人生存期不过数月。这在一定程度上显示出免疫节点抑制剂的良好功效和光明的前景,就发展成为扩散性黑色素瘤,然而此病的难治之处就在于一旦癌细胞扩散到其他组织中,因此MEK抑制剂也可以用于治疗BRAF突变的黑色素瘤患者。